Ցեզիումի բրոմիդ
Կաղապար:Տեղեկաքարտ Նյութ Ցեզիումի բրոմիդ, CsBr, բրոմի և ցեզիումի բինար, անօրգանական միացություն, բրոմաջրածնի ցեզիումային աղը։ Անգույն (բյուրեղային վիճակում) նյութ է՝ իոնային բյուրեղացանցով․ լավ է լուծվում ջրում, սուբլիմացիայի չի ենթարկվում, ունի ջերմային կայունություն։ CsBr-ի բյուրեղային ցանցը խորանարդային է, որը նման է CsCl-ի կառուցվածքին։
Մոլեկուլային և բյուրեղային կառուցվածք
Ցեզիումի բրոմիդը վառ արտահայտված իոնային կառուցվածքով նյութ է, որտեղ ամեն Cs+ իոն շրջապատված է բրոմի ութ Br− իոնով։ Իոնացման էներգիան կազմում է I = 7,78 Էվ[1]․[էջ 373]։ Ատոմացման էներգիան (Eատ)՝ 395 կՋ/մոլ[1]․[էջ 380]։ Ցեզիումի բրոմիդը գազային վիճակում առաջացնում է Cs2Br2 բանաձևով դիմեր միացություն, որն ունի շեղանկյուն կառուցվածք[2]։
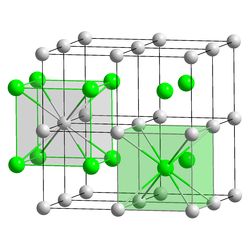
Միացության բյուրեղային ցանցը խորանարդային է, տարրական (α-CsBr), տարածական խումբը՝ P m3m, a = 0,429 նմ, Z = 1։
Տաքացման պայմաններում α-CsBr-ը մոդիֆիկացվում է՝ դառնալով β-CsBr (NaCl-ի նման)[3]․[էջ 91]։ Տարածական խումբը՝ F m3m, a = 0,723 նմ, Z = 4։ Բյուրեղային ցանցի էներգիան՝ U = 625,9 կՋ/մոլ[3]․[էջ 101]։ Cs-Br կապի երկարությունը գազային վիճակում կազմում է 307 պիկոմետր[2], հեղուկ վիճակում՝ 355 պիկոմետր, պինդ վիճակում՝ 362 պիկոմետր[4]։ Ցեզիումի բրոմիդի բյուրեղները հեղուկ գալիումի հետ տաքացնելիս դիլոկացիայի են ենթարկվում, հանգեցնում է անբնական ճկունության և միացության առաձգականության[5]։
Տարրերի զանգվածային բաժինները․ Cs 62,45 %, Br 37,55 %։
Ֆիզիկական հատկություններ
Ցեզիումի քլորիդը նորմալ պայմաններում անգույն (մեծ բյուրեղային տեսքով) կամ սպիտակ (փոշու նման) միացություն է, որը լավ է լուծվում ջրում (100 գ H2O-ում 123,3 գրամ CsBr՝ 50 °С-ում, 214 գ՝ 80 °С-ում)[1]․[էջ 620]։ Լուծման ջերմությունը ջրում, սենյակային պայմաններում կազմում է −25,96 կՋ/մոլ[6]։ Բյուրեղահիդրատներ չի առաջացնում[7]։ Ջրային լուծույթում բյուրեղանալով առաջացնում է անջուր խորանարդային բյուրեղներ կամ անջուր շեղանկյունաձև դոդեկաեդրեր[3]․[էջ 100]։
Ցեզիումի բրոմիդի ջրային լուծույթի խտությունը 20 °C ջերմաստիճանում[1]․[էջ 645]․
| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 14 % | |
|---|---|---|---|---|---|---|---|---|
| Խտություն, գ/լ | 1006,1 | 1014,1 | 1030,5 | 1047,3 | 1064,7 | 1082,7 | 1101,2 | 1120,3 |
| 16 % | 18 % | 20 % | 22 % | 24 % | 30 % | 35 % | 40 % | |
| 1140,1 | 1160,5 | 1181,7 | 1203,6 | 1226,3 | 1299,7 | 1367,6 | 1442,8 |
Միացությունը լուծվում է մեթանոլում, էթանոլում․ լավ է լուծվում մրջնաթթվում և հիդրազինում, վատ է լուծվում ացետոնում, եթերներում, պիրիդինում, ացետոննիտրիլում, նիտրոբենզոլում[7]։
Լավ է լուծվում բրոմաջրածնական թթվում։ CsBr-ի առավելագույն կոնցենտրացիայի և HBr-ի տարբեր կոնցենտրացիաների կախումը 25 °C ջերմաստիճանային պայմաններում[7]․
| HBr-ի կոնցենտրացիա, % | 5 % | 10 % | 15% | 20 % | 25 % |
|---|---|---|---|---|---|
| CsBr-ի կոնցենտրացիա, % | 49,0 | 40,6 | 33,3 | 27,9 | 23,4 |
Հիմնական թերմոդինամիկական բնութագրեր[1]․[էջ 462, 532]․ գազային վիճակում․
- ձևավորման հիմնական էնթալպիա - ΔHo298 = −208 կՋ/մոլ
- ձևավորման հիմնական էնթրոպիա - So298 = 267 Ջ/(մոլ·Կ)
- Գիբսի էներգիա - ΔGo298 = −240 կՋ/մոլ
բյուրեղային վիճակում
- ձևավորման հիմնական էնթալպիա - ΔHo298 = −392 կՋ/մոլ
- ձևավորման հիմնական էնթրոպիա - So298 = 117 Ջ/(մոլ·Կ)
- Գիբսի էներգիա - ΔGo298 = −379 կՋ/մոլ
Ստացում
Լաբորատոր պայմաններում ցեզիումի բրոմիդը ստացվում է հիդրօքսիդների, կարբոնատների, հիդրոկարբոնատների կամ սուլֆիդների և բրոմաջրածնական թթվի փոխազդեցությունից․
Մեկ այլ տարբերակ է ցեզիումի կարբոնատի և կալցիումի բրոմիդի կամ բարիումի բրոմիդի միջը փոխանակային ռեակցիայից․
Քիմիական հատկություններ
Ցեզիումի բրոմիդը բավականին կայուն միացություն է։ Գազային բաղադրությամբ՝ 2100-2400 կելվին պայմաններում, դիսոցման հաստատունը չի գերազանցում 0,025-ը[8]։
Ցեզիումի քլորիդի ջրային լուծույթը փոխազդում է հեղուկ բրոմի հետ, որի հետևանքով առաջանում է ցեզիումի դիբրոմբրոմատ[9]․
Քլորի հետ փոխազդելով առաջացնում է ցեզիումի դիքլորբրոմատ[10]․
Կիրառություն
- Մտնում է լյումինաֆորի բաղադրության մեջ՝ լյումինէսցենտային էկրանների համար, օգտագործվում է ռադիոգրության մեջ[11]։
- Համարվում է ալկալիական մետաղների աղբյուր՝ քրոմատոգրաֆիայի համար, օգտագործվում է ընտրողական գազային քրոմատոգրաֆիայի մեջ։
Ծանոթագրություններ
Կաղապար:Ծանցանկ Կաղապար:Արտաքին հղումներ
- ↑ 1,0 1,1 1,2 1,3 1,4 Կաղապար:Ռուսերեն գիրք
- ↑ 2,0 2,1 Կաղապար:Ռուսերեն գիրք
- ↑ 3,0 3,1 3,2 Կաղապար:Ռուսերեն գիրք
- ↑ Կաղապար:Ռուսերեն գիրք
- ↑ Կաղապար:Ռուսերեն գիրք
- ↑ Կաղապար:Ռուսերեն գիրք
- ↑ 7,0 7,1 7,2 Կաղապար:Ռուսերեն գիրք
- ↑ Կաղապար:Ռուսերեն հոդված
- ↑ Կաղապար:Ռուսերեն հոդված
- ↑ Կաղապար:Cite web
- ↑ Կաղապար:Ռուսերեն հոդված